Hvorfor Do Helium Balloons Deflate hurtigere?
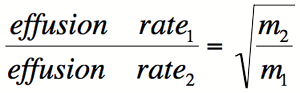
Heliumgas effuses eller undslipper fra balloner hurtigere end luft. Grunden til dette er, fordi det bevæger sig meget hurtigere end tungere gasmolekyler ved den samme temperatur. En almindelig misforståelse er, at en forskel i atomar størrelse er, hvad forklarer forskellen i effusion satser, men denne relation er ikke bekræftet af eksperimenter.
En misforståelse
En almindelig misforståelse er, at helium undslipper fra balloner hurtigere end luft, fordi heliumatomer er mindre, og kan derfor passe gennem huller i elastiske bedre. Dette kan endda synes at være bakket op eksperimentelt. For eksempel hydrogen undslipper langsommere end helium og brint molekyler er større end helium-molekyler, fordi de er diatomiske. Men når størrelsen af gas atomer måles, er forskellene størrelse ikke hænger pænt de observerede effusion rentesatsforskelle.
Eksperimentelle resultater
I betragtning af hvad vi ved om atomare størrelser, der er ikke meget variation i størrelse mellem luftmolekyler. For eksempel nitrogen, den førende bestanddel af luft, afviger i radius fra helium med en faktor på kun ca. 50%, men adskiller sig fra helium i effusionshastighed betydeligt mere end 50%. Neon er praktisk taget den samme størrelse som helium men effuses meget langsommere end helium.
Grahams lov af Effusionsmetoden
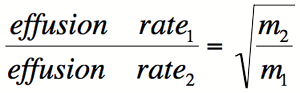
Før var kendt atomare radier, skotske kemiker Thomas Graham opdagede en empirisk sammenhæng mellem antallet af effusion og molekylvægt. Relationen kan angives som det fremgår af diagrammet, hvor M1 og M2 står for de molekylære masser af gas 1 og gas 2.
Kinetic gasteori
Forklaringen på Grahams teori måtte vente til den kinetiske teori for gasser blev udviklet i slutningen af det 19. århundrede. En af de største bidrag fra den kinetiske teori for gasser var afsløringen af, at temperaturen af en gas, som målt på Kelvin, er proportional med den kinetiske energi i gassen, og derfor dens masse og kvadratet af dets gennemsnitlige hastighed . Dette betyder, at hvis to gasser er ved den samme temperatur, deres kinetiske energi er den samme. Hvis man er dobbelt så massiv, vil den anden gennemsnit en hastighed fire gange så hurtigt. Da effusion er et mål for partikler, der gennemkører et område i en periode ville hastighedsforskelle drive forskellen i effusion satserne mellem forskellige molekyler.
Afledning
Graham lov kan derfor let udledes fra den kinetiske teori. Start med observationen ovenfor, at effusion satser er proportional med gennemsnitlig hastighed, fordi effusion er satsen en gas molekyle passerer gennem et område. v (1) α effusionshastighed 1 og v (2) α effusionshastighed 2. Som anført ovenfor to gasser lig temperatur lige kinetisk energi. Så KE1 = KE2. Så m1 --- v1 ^ 2 = m2 --- V2 ^ 2. Vi kan undgå at skulle bekymre sig om proportionalitetskonstanter ved blot beskæftiger sig i forhold, således at proportionalitetskonstanter annullere ud. Derfor √ [m1 / m2] = v2 / v1 = effusion rate 2 ÷ effusion rate 1, hvilket giver os Grahams lov af effusion.
