Må ionforbindelser opløses i vand?
I ioniske forbindelser, mindst ét atom donerer en elektron til et andet atom, binde to atomer sammen som en magnet. Hvis opløst i et opløsningsmiddel, der bryder ionbinding, den del af molekylet med en yderligere elektron er en negativ ion kaldes en anion, mens den anden del af molekylet med færre elektroner er en positiv ion eller kation. Vand, der også betegnes som den universelle opløsningsmiddel, interagerer med ioniske forbindelser og kovalente polære forbindelser.
Vand Egenskaber
Vand (H₂O) er et oxid af hydrogen og har en pH på syv (neutral). Et vandmolekyle er formet som en mus hoved, hvor de to hydrogenatomer er "ører" af oxygenatom. Vand er en dipol, hvilket betyder at det har to poler i elektrisk ladning. Positive ladninger er i den ene ende med hydrogen, og den negative ladning er på oxygen ende. På trods af dette, vand er ikke ioniske. Det kan opløse polære stoffer, og dens polaritet gør det muligt at opløse ioniske stoffer.
Vand som opløsningsmiddel
For at vise hvor polar vandmolekyler opløse forbindelser, overveje hydrogenchlorid (HCl) gas. Ren, tør hydrogenchloridgas er kovalent bundet (dvs. atomer deler elektroner), og ikke ioniserer. Når det opløses i vand, men HCI-molekyler opdeles i ioner på denne måde: H₂O + H-Cl 'H₃O⁺ + Cl - The hydrogen af gassen tillægger elektron-rige bagsiden af oxygen, danner en hydronium kation, H₃O⁺. Denne "trække" proces er stærk nok til at bryde hydrogen-chlor binding.
Ionforbindelser
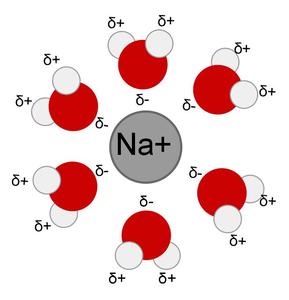
Ionforbindelser opløses lige så let, da de er fuldt opladet. I den ioniske forbindelse natriumchlorid, er natrium- og chloratomer ladet på grund af en elektron overførsel fra natrium til chlor. Ilt vand har en lidt negativ ladning, og er hentet til den stærke positive ladning på natrium. De lidt positive hydrogenatomer vand trækkes til den fulde negative ladning af chlor anion. Vinder de udskilte natrium- og chloridioner omgivet af vandmolekyler.
Polære, ioniske Opløsningsmidler
Polære, ikke-ioniske opløsningsmidler er ikke tegnet ionforbindelser, og i virkeligheden er der ingen energi "incitament" for sådanne forbindelser for at opløse. Energi er reaktioner lidt ligesom penge er til erhvervslivet - det er den drivende kraft for aktivitet.
Særlige forbindelser
Visse forbindelser har molekyler, der er store i størrelse, idet det meste ikke-polære og kovalent i natur, og samtidig have en ionisk del ved den ene ende. For eksempel angiver kovalente, upolære del med X'er, kunne en struktur se således ud: XXXXXXXXXXXXXXXXXXXX- (COO) ⁻ Na I dette tilfælde en oliebaseret stof såsom olie kan blive draget til den lange kæde repræsenteret her ved X'er , mens vand henledes på natrium kation og carboxylsyre anion (-COO⁻). Alle tre arter (den ene trukket ovenfor repræsenterer en detergent) er således fastgjort, og olien er for alle praktiske formål, opløst i vand.
